Lonza Amaxa 4D-Nucleofector╝Ü░¹║╦▐D╚ŠŽĄĮy
——▓Ė╚ķäė(d©░ng)╬’šµ║╦╝Ü░¹Ė▀ą¦╗∙ę“▐D╚Š

Ą┬ć°▀M(j©¼n)┐┌Lonza 4D-Nucleofector╝Ü░¹║╦▐D╚ŠŽĄĮyŻ©įŁAmaxa 4D-Nucleofector║╦▐DāxŻ®�Ż¼äō(chu©żng )ą┬ąįĄžĮY║ŽĮø(j©®ng)ĄõļŖ┤®┐ū╝╝ąg(sh©┤)║═╝Ü░¹╠ž«ÉąįļŖ▐D╚Šę║�����Ż¼īŹ(sh©¬)¼F┴╦DNA�����ĪóRNA(╚ńcrRNA����ĪótracrRNA���ĪógRNA�ĪósgRNA)��ĪóRNP║╦╠Ū║╦Ą░░ūÅ═║Ž¾w�����ĪóĄ░░ū┘|(zh©¼)Ż©╚ńCas9║╦╦ß├Ė����ĪóŪą┐┌├Ė��ĪódCas9Ą░░ū�����ĪóCas12a/Cpf1║╦╦ß├ĖŻ®�ĪóąĪĘųūė╬’┘|(zh©¼)Ė▀ą¦▐D╚ŠĖ„ŅÉ(l©©i)▓Ė╚ķäė(d©░ng)╬’┘N▒┌╝Ü░¹�ĪóæęĖĪ╝Ü░¹�Īó═Ō├┌¾wexosomeĄ╚����ĪŻ
ą┬┐ŅLonza 4D║╦▐Dāxė╔ė├ė┌ąĪęÄ─Ż▐D╚ŠĄ─X─ŻēKŻ©4D-Nucleofector X UnitŻ®���Īó┘N▒┌╝Ü░¹▓╗Įø(j©®ng)Ž¹╗»▀M(j©¼n)ąąįŁ╬╗▐D╚ŠĄ─Y─ŻēKŻ©4D-Nucleofector Y UnitŻ®����Īóå╬ę╗╝Ü░¹┤¾ęÄ─Ż┴„╩Į▐D╚ŠĄ─LV─ŻēKŻ©4D-Nucleofector LV UnitŻ®�����ĪóĖ▀═©┴┐║Y▀xĄ─96┐ū─ŻēKŻ©įŁ96-well Shuttle DeviceŻ®ĮM│╔����ĪŻ ³c(di©Żn)ō¶▓ķ┐┤Ż║Lonza Nucleofector 2B Device å╬┐ū║╦▐Dāx2Bą═╠¢
Lonza 4D-Nucleofector╝╝ąg(sh©┤)▓╗ę└┘ć(l©żi)ė┌╝Ü░¹ėąĮzĘų|┴č�Ż¼▓╗╩▄╝Ü░¹į÷ų│Ą─ė░Ēæ��Ż¼┐╔ų▒Įėīó═Ōį┤╗∙ę“ī¦╚ļ╝Ü░¹║╦ųą�Ż¼╝┤╩╣╩Ū╬┤Ęų|┴čĄ─įŁ┤·╝Ü░¹Ż©╚ńņoų╣Ą─T┴▄░═╝Ü░¹╗“╔±Įø(j©®ng)į¬Ż®��Ż¼ę▓┐╔ęį┐ņ╦┘▒Ē▀_���ĪŻ
Lonza 4D-Nucleofectorī”┘|(zh©¼)┴ŻDNA▐D╚Šą¦┬╩Ė▀▀_90Żź�Ż¼╣č║╦▄š╦߯©╚ńsiRNAŻ®▐D╚Šą¦┬╩Ė▀▀_99Żź�Ż¼├µ╩└20─ĻüĒ(l©ói)���Ż¼ęč│╔╣”▐D╚ŠŻŠ1200ĘN╝Ü░¹ŽĄ�ĪóŻŠ130ĘNįŁ┤·╝Ü░¹�����Ż¼▓óį┌Ė╔╝Ü░¹����Īó├Ōę▀╝Ü░¹��Īó╔±Įø(j©®ng)╝Ü░¹Ą╚Ė„ŅÉ(l©©i)▌^ļy▐D╚ŠĄ─╝Ü░¹�����Īóęį╝░═Ō├┌¾wļŖ┤®┐ūčb▌d╦Ä╬’ųą½@Ą├┴╦ā×(y©Łu)ąŃĄ─ą¦╣¹�ĪŻ
ė╔ė┌═¼ĘN╝Ü░¹ŽĄ╗“įŁ┤·╝Ü░¹╩╣ė├ŽÓ═¼Ą─▐D╚ŠŚl╝■Ż©▐D╚Š│╠ą“║═▐D╚Šįćä®║ąŻ®��Ż¼Lonza 4D-Nucleofector┐╔īŹ(sh©¬)¼FČÓĘN═Ōį┤╬’┘|(zh©¼)╣▓▐D╚Š��Ż¼└²╚ńCRISPR-Cas9╗∙ę“ŠÄ▌ŗĢr(sh©¬)╣▓▐D╚Š2ĘNsgRNAĄ╚�ĪŻ
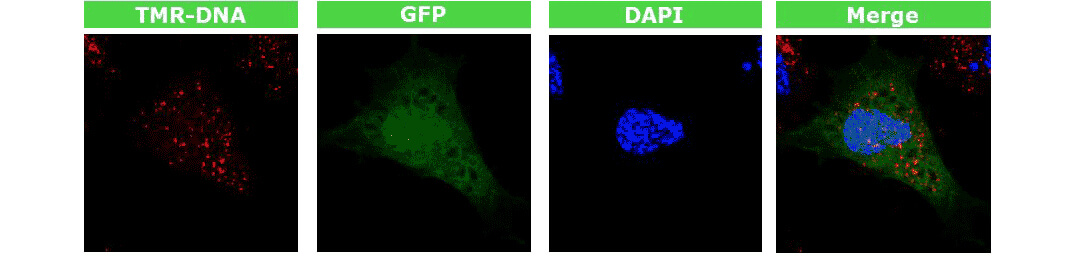
łD. GFPś╦ėøĄ─┘|(zh©¼)┴Ż▐D╚Šą┬╔·ā║Ųż─w│╔└wŠS╝Ü░¹���Ż¼2ąĪĢr(sh©¬)║¾ė├3.5% PFA ╣╠Č©��Ż¼╣▓Š█Į╣’@╬óńR┐╔ė^(gu©Īn)▓ņĄĮGFPĄ░░ūį┌╝Ü░¹║╦ā╚▒Ē▀_���ĪŻ
4D-Nucleofector╝Ü░¹║╦▐D╚ŠĘĮĘ©╠ž³c(di©Żn)
1.ßśī”├┐ĘN╝Ü░¹ā×(y©Łu)╗»Ą─ļŖ├}ø_ģóöĄ��Ż¼┐╔īóĄū╬’ī¦╚ļ╝Ü░¹┘|(zh©¼)╔§ų┴╩Ū╝Ü░¹║╦����Ż╗
2.╠ž╩Ō┼õĘĮĄ─ļŖ▐D╚Šę║����Ż¼═¼Ģr(sh©¬)╠ß╣®Ė▀▐D╚Šą¦┬╩║═╝Ü░¹▒Żūo����Ż¼╠ßĖ▀╝Ü░¹▐D╚Š║¾┤µ╗Ņ┬╩����Ż╗
3.╚½Ū“╣▓ŽĒöĄō■Äņ����Ż¼īŻ(zhu©Īn)śI(y©©)ųĖī¦�Ż¼Å─╝Ü░¹üĒ(l©ói)į┤����Īóé„┤·��Īó┼ÓBŚl╝■����Īó┼ÓB╗∙����Īó▐D╚Š│╠ą“▀xō±║═▓┘ū„╝╝Ū╔��ĪóĄĮ▐D╚Š║¾┼ÓB╝╝Ū╔�Ż¼ęčą╬│╔│╔╩ņĄ─īŹ(sh©¬)“×ĘĮ░Ė����ĪŻ
4D-Nucleofector║╦▐D╚ŠŽĄĮy×ķ╗∙ę“ų╬»¤čąŠ┐�Īó├Ōę▀ų╬»¤čąŠ┐�ĪóĖ╔╝Ü░¹čąŠ┐Ą╚╠ß╣®┴╦ĘĮ▒ŃĄ─╣żŠ▀��ĪŻŽÓ▒╚ļŖ┤®┐ūį┌ā╚Ą─Ųõ╦¹ĘŪ▓ĪČŠ▐D╚Š╝╝ąg(sh©┤)��Ż¼Ė³Š▀ā×(y©Łu)ä▌Ż║
-▓╔ė├Ė▀ĘųūėŠ█║Ž╬’ļŖśO�����Ż¼▒▄├Ōé„ĮyõXļŖśOĄ─ļxūėČŠ║”�Ż¼ŠS│ų╝Ü░¹╔·└ĒĀŅæB(t©żi)���Ż¼╠ßĖ▀┤µ╗Ņ┬╩�����ĪŻ
-▐D╚Š║¾┐╔┐ņ╦┘ė^(gu©Īn)▓ņīŹ(sh©¬)“×ĮY╣¹��Ż¼└²╚ń▐D╚ŠGFP║¾ūŅ┐ņ2ąĪĢr(sh©¬)┐╔ė^(gu©Īn)▓ņĄĮĄ░░ū�ĪŻ
-¤o(w©▓)ąĶūį╝║ā×(y©Łu)╗»Śl╝■����Ż¼ōĒėą│¼▀^(gu©░)759ĘN╝Ü░¹ŅÉ(l©©i)ą═Ą─¼F│╔│╠ą“����Ż¼┐╔ų▒Įė╩╣ė├��Ż¼╚½Ū“╣▓ŽĒöĄō■Äņ��Ż¼│¼▀^(gu©░)1500Śl▐D╚ŠöĄō■┐╔╣®ģó┐╝����Ż¼▓ó│ų└mĖ³ą┬�ĪŻ
-┐╔▐D╚Š░³└©DNA��ĪómRNA�ĪómiRNA���ĪósiRNA��ĪóRNP�Īóļ─����ĪóĄ░░ū┘|(zh©¼)���ĪóąĪĘųūė╗»║Ž╬’į┌ā╚Ą─ČÓĘNĄū╬’���ĪŻ
-┐╔ė├ė┌ļyęį▐D╚ŠĄ─įŁ┤·╝Ü░¹���ĪóĖ╔╝Ü░¹���Īó╔±Įø(j©®ng)į¬���Īó╝Ü░¹ŽĄ���Ż¼ęį╝░═Ō├┌¾w
-┐╔▓╗ė├Ž¹╗»╝Ü░¹���Ż¼▀M(j©¼n)ąą┘N▒┌╝Ü░¹Ą─įŁ╬╗▐D╚Š��ĪŻ
-ņ`╗ŅĄ─▐D╚ŠęÄ─����Ż┐sĘ┼��Ż¼┐╔į┌Ą═�����Īóųą���ĪóĖ▀═©┴┐ųą▌p╦╔▐DęŲ�����Ż¼īŹ(sh©¬)¼F2×10^4ų┴1×10^9éĆ(g©©)╝Ü░¹öĄ┴┐Ą─▌p╦╔öUš╣�����ĪŻ
-╚½Ū“░l(f©Ī)▒Ē╬─š┬│¼▀^(gu©░)14,000Ų¬��ĪŻ
ūŅĮ³���Ż¼Lonza 4D-Nucleofector║╦▐D╚ŠŽĄĮyęčÅVĘ║æ¬ė├ė┌═©▀^(gu©░)RNAi�ĪóCRISPR-Cas9�ĪóCRISPR-Cas12a▀M(j©¼n)ąąĄ─╗∙ę“Ū├│²čąŠ┐�����Īóęį╝░iPSšTī¦ČÓ─▄Ė╔╝Ü░¹����ĪóCAR-NK��ĪóCAR-T����Īó═Ō├┌¾w╦Ä╬’▀f╦═Ą─蹊┐ųą�����Ż¼į┌░³└©╣”─▄║═ĮYśŗ╗∙ę“ĮMīW(xu©”)�����Īó╦Ä╬’░l(f©Ī)¼Fęį╝░╗∙ę“║═╝Ü░¹»¤Ę©Ą─蹊┐ųą┤¾Ę┼«É▓╩�����ĪŻ
4D║╦▐DāxĮYśŗ║═╣”─▄æ¬ė├Ż║
4D-Nucleofector╝Ü░¹║╦▐D╚ŠŽĄĮy▓╔ė├─ŻēK╗»įOėŗ���Ż¼┐╔Ė∙ō■蹊┐š▀Ą─ąĶŪ¾���Ż¼ūįąąĮM║ŽöĄéĆ(g©©)─ŻēKą╬│╔ę╗╠ū═Ļš¹ŽĄĮy�ĪŻ
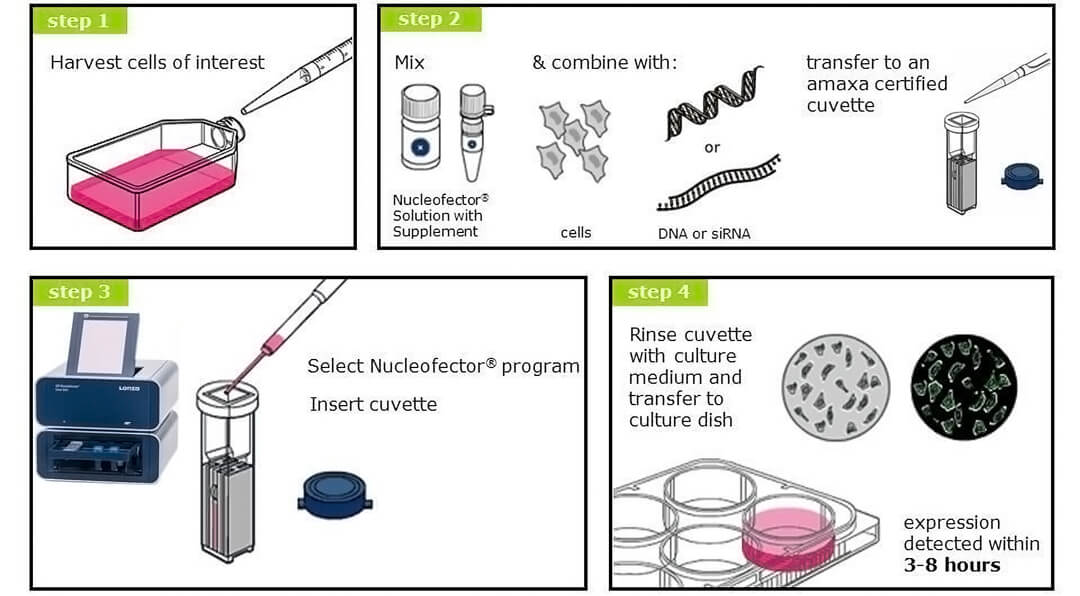
1�ĪóC─ŻēKŻ║4D-NucleofectorŽĄĮyĄ─┐žųŲå╬į¬���Ż¼ā╚ų├▐D╚Š│╠ą“�Ż¼īó▓╗═¼Ą─╣”─▄å╬į¬Ż©─ŻēKŻ®š¹║Ž×ķę╗éĆ(g©©)ŽĄĮy����Ż¼ęį▀\ąą▓╗═¼Ą─æ¬ė├│╠ą“�����ĪŻ

2�����ĪóX─ŻēKŻ║ė├ė┌æęĖĪ╝Ü░¹����Īó╗“┘N▒┌╝Ü░¹Ž¹╗»║¾Ą─ąĪęÄ─Ż▐D╚Š�����Ż¼▐D╚Š╝Ü░¹öĄ┴┐2×10^4ų┴2×10^7�����Ī��Ż┐╔═¼Ģr(sh©¬)▐D╚Š2éĆ(g©©)100μLļŖ▐D▒Ł�����Īó1éĆ(g©©)16┐ūļŖ▐D░ÕŚlŻ©├┐┐ū20μLŻ®�����Ż¼├┐éĆ(g©©)ļŖ▐D▒Ł��Īó├┐éĆ(g©©)┐ū┐╔¬Ü┴óįOų├│╠ą“���ĪŻ┴Ē═Ōį┌╩╣ė├96┐ū─ŻēKĢr(sh©¬)�����Ż¼ę▓ąĶę¬X─ŻēK�ĪŻ

3�����ĪóY─ŻēKŻ║ė├ė┌┘N▒┌╝Ü░¹▓╗Įø(j©®ng)Ž¹╗»Ą─įŁ╬╗▐D╚Š���Ż¼┐╔═¼Ģr(sh©¬)▐D╚Š1éĆ(g©©)24┐ūļŖ▐D░ÕŚlŻ©├┐┐ū350μLŻ®���Ż¼├┐éĆ(g©©)┐ū┐╔¬Ü┴óįOų├│╠ą“�����ĪŻ

4�ĪóLV─ŻēKŻ║ė├ė┌═¼ę╗ĘNæęĖĪ╝Ü░¹����Īó╗“═¼ę╗ĘN┘N▒┌╝Ü░¹Ž¹╗»║¾Ą─┤¾ęÄ─Ż▐D╚Š���Ż¼▐D╚Š╝Ü░¹öĄ┴┐1×10^7ų┴2×10^9�����Ī���Ż┐╔╩╣ė├1mL╩ųäė(d©░ng)▀M(j©¼n)śėļŖ▐D▒P(p©ón)��Īó╗“20mL▀B└m▀M(j©¼n)śėļŖ▐D▒P(p©ón)�����ĪŻ═©│Ż╩╣ė├X─ŻēKąĪįć├■Śl╝■����Ż¼į┘ė├LV─ŻēKŠĆ(xi©żn)ąįĘ┼┤¾▐D╚ŠęÄ─Ż�����ĪŻ

5��Īó96┐ū─ŻēKŻ║ė├ė┌═¼Ģr(sh©¬)▐D╚Š96éĆ(g©©)śėŲĘĄ─╝Ü░¹�Ż¼▐D╚Š╝Ü░¹öĄ┴┐2×10^4ų┴1×10^6�ĪŻ├┐éĆ(g©©)┐ū┐╔¬Ü┴óįOų├│╠ą“��ĪŻ▒žĒÜ┼cX─ŻēKĮY║Ž╩╣ė├���ĪŻ

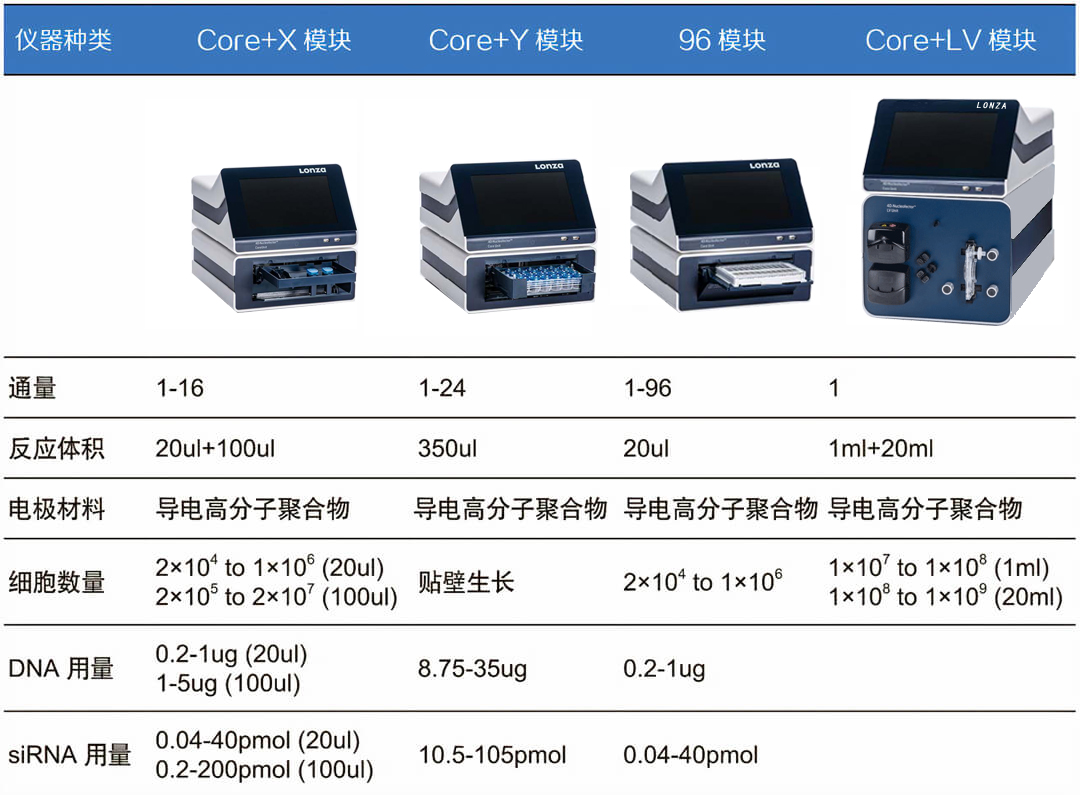
ūóŻ║│Żė├─ŻēKĮM║Žģó┐╝
│ŻęÄąĪęÄ─Ż▐D╚ŠŻ║C+X
┘N▒┌╝Ü░¹įŁ╬╗▐D╚ŠŻ║C+Y
æęĖĪ+┘N▒┌╝Ü░¹▐D╚ŠŻ║C+X+Y
┤¾ęÄ─Ż▐D╚ŠŻ║C+X+LV
├■╦„Å═ļs▐D╚ŠŚl╝■Ż║C+X+96┐ū
Lonza 4D-Nucleofector╝Ü░¹║╦▐D╚ŠŽĄĮyģóöĄ
| ŲĘ┼Ų |
Lonza²ł╔│ |
| «a(ch©Żn)Ąž |
Ą┬ć°┐Ų┬Ī |
| ├¹ĘQ(ch©źng) |
4D-Nucleofector╝Ü░¹║╦▐D╚ŠŽĄĮy |
| ą═╠¢ |
4D |
| žø╠¢ |
AAF-1003B |
Core─ŻēK�Ż¼║å(ji©Żn)ĘQ(ch©źng)C─ŻēK |
| ĪĪ |
AAF-1003X |
X─ŻēK |
| ĪĪ |
AAF-1003Y |
Y─ŻēK |
| ĪĪ |
AAF-1002L |
LV─ŻēK |
| ĪĪ |
AAM-1003S |
96┐ū─ŻēK |
| ė├═Š |
ė├ė┌Ė╔╝Ü░¹�����ĪóįŁ┤·╝Ü░¹��Īó╝Ü░¹ŽĄĄ─Ė▀ą¦▐D╚Š |
| ▀mė├╝Ü░¹ |
┘N▒┌╝Ü░¹��ĪóæęĖĪ╝Ü░¹�����Ż¼░³└©ļy▐D╚ŠĄ─č¬ę║ŽĄĮy╝Ü░¹║═Ė╔╝Ü░¹��Ż¼═Ō├┌¾w |
| ▐D╚Š╬’ |
┘|(zh©¼)┴Ż�����ĪóDNA����ĪóRNA�����ĪóRNP�����ĪóĄ░░ū┘|(zh©¼)��ĪóąĪĘųūė╗»║Ž╬’Ą╚ |
| õN(xi©Īo)╩█╩┌ÖÓ |
ųąć°┤¾Ļæę╗╝ē┤·└ĒŻ©▓╗║¼Ė█░─┼_Ż® |
| ār(ji©ż)Ė± |
įā(x©▓n)ār(ji©ż) |
| žøŲ┌ |
C+Xć°ā╚¼Fžø1ų▄ |
| C+LVć°ā╚¼Fžø1ų▄ |
| Ųõ╦¹ą═╠¢4-6ų▄ |
| Ę■äš(w©┤) |
╩█Ū░╝╝ąg(sh©┤)ū╔įā(x©▓n)����Ż¼čbÖC�Ż¼╩█║¾Ę■äš(w©┤)Ż©╩█║¾Ž▐▒▒Š®Ø╔ŲĮõN(xi©Īo)╩█āxŲ„Ż® |
ę²ė├╬─½IŻ║
1.Synchronous Disintegration of Ferroptosis Defense Axis via Engineered Exosome-Conjugated Magnetic Nanoparticles for Glioblastoma Therapy. Boyan Li, et al. Advanced Science, May 4, 2022
2.Mouse brain-wide transgene expression by systemic injection of genetically engineered exosomes: CAP-Exosomes. Saumyendra N Sarkar, Debora Corbin, James W Simpkins. bioRxiv, April 9, 2022
3.Engineering of CRISPR-Cas12b for human genome editing.Strecker J, et al. Nature (2019) 10(1): 212
4.Gene correction for SCID-X1 in long-term hematopoietic stem cells.Pavel-Dinu M, et al. Nat Commun. (2019) 10 (1): 1634
5.Orthotopic replacement of T-cell receptor a- and ?-chains with preservation of near-physiological T-cell function.Schober K, et al. Nat Biomed Eng (2019) 10: 01
6.Ribonucleoprotein Transfection for CRISPR/Cas9-Mediated Gene Knockout in Primary T Cells.Oh SA, et al. Curr Protoc Immunol (2019) 124(1): e69
7.Polymer-stabilized Cas9 nanoparticles and modified repair templates increase genome editing efficiency.Nguyen DN, et al. Nat Biotechnol (2019) 1: 1
8.CRISPR-Cas9 genome engineering of primary CD4+ T cells for the interrogation of HIV-host factor interactions. Hultquist JF, et al. Nat Protocols (2019) 14(1): 1-27
9.Bacteria-free minicircle DNA system to generate integration-free CAR-T cells.Chen Cheng, et al. J Med Genetics (2019) 56: 10–17
10.Genome-wide CRISPR Screens in Primary Human T Cells Reveal Key Regulators of Immune Function. Shifrut E, et al. Cell (2018) 175(7): 1985-1971
11.Guide Swap enables genome-scale pooled CRISPR-Cas9 screening in human primary cells. Ting PY, et al. Nat Methods (2018) 15(11)
12.Cytokines induced killer cells produced in good manufacturing practices conditions: identification of the most advantageous and safest expansion method in terms of viability, cellular growth and identity.Castiglia S,et al.J Transl Med (2018) 16: 237
13.A high-fidelity Cas9 mutant delivered as a ribonucleoprotein complex enables efficient gene editing in human hematopoietic stem and progenitor cells. Vakulskas CA,et al.Nat Med (2018) 24(8): 1216-1224
14.Reprogramming human T cell function and specificity with non-viral genome targeting.Roth TL,et al.Nature (2018) 559: 405-9
15.Nucleofection with Plasmid DNA for CRISPR/Cas9-Mediated Inactivation of Programmed Cell Death Protein 1 in CD133-Specific CAR T Cells.Hu B,et al.Hum Gene Ther (2018)
16.Optimized RNP transfection for highly efficient CRISPR/Cas9-mediated gene knockout in primary T cells.Seki A,et al.J Exp Med (2018) 215(3): 985-997
17.Improved Expansion and In Vivo Function of Patient T Cells by a Serum-free Medium.Medvec AR,et al.Mol Ther Methods Clin Dev. (2017) 7; 8: 65-74
18.Going non-viral: the Sleeping Beauty transposon system breaks on through to the clinical side.Hudecek M1,et al.Clin Exp Immunol (2017) 52(4): 355(80)
19.CRISPR-Mediated Integration of Large Gene Cassettes Using AAV Donor Vectors.Bak RO,et al.Cell Rep (2017) 20(3): 750-756
20.CRISPR-Cas9 mediated LAG-3 disruption in CAR-T cells.Zhang Y,et al.Frontiers in Immunology (2017) 1: 1-9
21.CRISPR/Cas9-mediated PD-1 disruption enhances anti-tumor efficacy of human chimeric antigen receptor T cells.Rupp LJ1,et al.Scientific Reports (2017) 7 (1): 737
22.A genome-wide CRISPR screen identifies a restricted set of HIV host dependency factors.Park RJ, et al.Nat Genet (2017) 49(2): 193-203
4D-Nucleofector╝Ü░¹║╦▐DŽĄĮy▐D╚ŠRNPę²ė├╬─½I
1. Seki A, Rutz S. Optimized RNP transfection for highly efficient CRISPR/Cas9-mediated gene knockout in primary T cells. J Exp Med. 2018 Mar 5;215(3):985-997. doi: 10.1084/jem.20171626. Epub 2018 Feb 7. PMID: 29436394; PMCID: PMC5839763.
2. Oh SA, Seki A, Rutz S. Ribonucleoprotein Transfection for CRISPR/Cas9-Mediated Gene Knockout in Primary T Cells. Curr Protoc Immunol. 2019 Feb;124(1):e69. doi: 10.1002/cpim.69. Epub 2018 Oct 18. PMID: 30334617.
3. Naeimi Kararoudi M, Dolatshad H, Trikha P, Hussain SA, Elmas E, Foltz JA, Moseman JE, Thakkar A, Nakkula RJ, Lamb M, Chakravarti N, McLaughlin KJ, Lee DA. Generation of Knock-out Primary and Expanded Human NK Cells Using Cas9 Ribonucleoproteins. J Vis Exp. 2018 Jun 14;(136):58237. doi: 10.3791/58237. PMID: 29985369; PMCID: PMC6101749.
4. Farboud B, Jarvis E, Roth TL, Shin J, Corn JE, Marson A, Meyer BJ, Patel NH, Hochstrasser ML. Enhanced Genome Editing with Cas9 Ribonucleoprotein in Diverse Cells and Organisms. J Vis Exp. 2018 May 25;(135):57350. doi: 10.3791/57350. PMID: 29889198; PMCID: PMC6101420.
5. Dewari PS, Southgate B, Mccarten K, Monogarov G, O'Duibhir E, Quinn N, Tyrer A, Leitner MC, Plumb C, Kalantzaki M, Blin C, Finch R, Bressan RB, Morrison G, Jacobi AM, Behlke MA, von Kriegsheim A, Tomlinson S, Krijgsveld J, Pollard SM. An efficient and scalable pipeline for epitope tagging in mammalian stem cells using Cas9 ribonucleoprotein. Elife. 2018 Apr 11;7:e35069. doi: 10.7554/eLife.35069. PMID: 29638216; PMCID: PMC5947990.
6. Daniel P. Dever1, Rasmus O. Bak1, Andreas Reinisch2, Joab Camarena1, Gabriel Washington1, Carmencita E. Nicolas1,
Mara Pavel-Dinu1, Nivi Saxena1, Alec B. Wilkens1, Sruthi Mantri1, Nobuko Uchida3, Ayal Hendel1, Anupama Narla4,
Ravindra Majeti2, Kenneth I. Weinberg1 & Matthew H. Porteus1. CRISPR/Cas9 β-globin gene targeting in human haematopoietic stem cells.2016 Springer Nature doi:10.1038 (╩╣ė├4D-Nucleofector LV┤¾ęÄ─Ż┴„╩Į║╦▐D╚ŠŽĄĮy▐D╚ŠRNP)
▒▒Š®Ø╔ŲĮūį2009─ĻŲų┴2024─Ļ▀B└m16─Ļū„×ķL(ch©óng)onzaųąć°ę╗╝ē┤·└Ē╔╠�����Ż¼ķL(ch©óng)Ų┌ĘĆČ©õN(xi©Īo)╩█Lonza╚½ŽĄ┴ą«a(ch©Żn)ŲĘ�Ż¼░³└©4D-Nucleofector║╦▐Dāx║═║╦▐Dįćä®║ą��ĪóX-VIVO¤o(w©▓)č¬ŪÕ┼ÓB╗∙��Īó╚╦įŁ┤·╝Ü░¹║═įŁ┤·┼ÓB╗∙�ĪóGS╗∙ę“▒Ē▀_ŽĄĮyė├CHO╝Ü░¹┼ÓB╗∙║═ča┴Ž��ĪóCOCOON╚½ĘŌķ]ūįäė(d©░ng)╗»╝Ü░¹╔·«a(ch©Żn)ŲĮ┼_����Īóų¦įŁ¾wÖz£yįćä®║ą║═āxŲ„��Īóā╚ČŠ╦žÖz£yįćä®║ą║═├Ėś╦āx�ĪóŁéų¼╠Ū║═ķW─z��ĪóMODAīŹ(sh©¬)“×╩ę╣▄└ĒŽĄĮyĄ╚�����Ż¼į┌ųąć°┤¾ĻæĄžģ^ČÓ─ĻĄ─╩ął÷(ch©Żng)═ŲÅVųą����Ż¼æ{ĮĶš\ą┼Įø(j©®ng)ĀI(y©¬ng)�����ĪóīŻ(zhu©Īn)śI(y©©)Ę■äš(w©┤)����Ż¼┌A(y©¬ng)Ą├┴╦▒ŖČÓĖ▀ąŻ���Īó┐Ųčąį║╦∙����Īó╔·«a(ch©Żn)Ų¾śI(y©©)蹊┐╚╦åTĄ─šJ┐╔�Ż¼▓óū„×ķL(ch©óng)onzaųąć°Ąžģ^ųžę¬║Žū„╗’░ķ�Ż¼ČÓ┤╬½@Ą├╝╬¬ä�����ĪŻ
ó┘Lonza╣┘ĘĮ╩┌ÖÓ����Ż¼═Ļš¹▀M(j©¼n)┐┌╩ų└m�����Ż¼š²ŲĘ▒ŻūC
ó┌īŻ(zhu©Īn)śI(y©©)╝╝ąg(sh©┤)ų¦│ųłFĻĀ����Ż¼ųą╬─ū╔įā(x©▓n)Ę■äš(w©┤)����Ż¼ĮŌøQīŹ(sh©¬)“×å¢(w©©n)Ņ}
ó█═Ļ╔ŲõN(xi©Īo)╩█┴„│╠����Ż¼╩█Ū░��Īó╩█║¾Ę■äš(w©┤)
ó▄ųąć°Ąžģ^ę╗╝ē┤·└Ē╔╠���Ż¼ā×(y©Łu)ä▌ār(ji©ż)Ė±���Ż¼žøį┤Ė³│õūŃ�����Ż¼¤ßõN(xi©Īo)ŲĘ¼FžøõN(xi©Īo)╩█
³c(di©Żn)ō¶ėęé╚į┌ŠĆ(xi©żn)ū╔įā(x©▓n)��Ż¼├Ō┘Mū╔įā(x©▓n)4D-Nucleofector║╦▐D╚ŠŽĄĮy╝╝ąg(sh©┤)å¢(w©©n)Ņ}+½@╚Īł¾ār(ji©ż)+╔Ļšłįćė├
——Lonzaųąć°ę╗╝ē┤·└Ē╔╠����Ż¼▒▒Š®Ø╔ŲĮ
ŽÓĻP(gu©Īn)«a(ch©Żn)ŲĘ
Lonza 4D-Nucleofector LV┤¾ęÄ─Ż┴„╩Į╝Ü░¹║╦▐D╚ŠŽĄĮy
Lonza 2B╝Ü░¹║╦▐D╚ŠŽĄĮy
Lonza 4D/2b-Nucleofector ╝Ü░¹║╦▐D╚Šįćä®║ą
Lonza X-VIVO¤o(w©▓)č¬ŪÕ┼ÓB╗∙����ĪóĖ╔╝Ü░¹┼ÓB╗∙��ĪóįŁ┤·╝Ü░¹┼ÓB╗∙���Īó│ŻęÄ┼ÓB╗∙
Lonza ╚╦įŁ┤·╝Ü░¹
Lonza ų¦įŁ¾wÖz£y���ĪóŪÕ│²��ĪóŅAĘ└įćä®║ą��ĪóLucetta 2░l(f©Ī)╣ŌÖz£yāx
Lonza ā╚ČŠ╦žÖz£yįćä®║ą/„cįćä®�Īóā╚ČŠ╦žīŻ(zhu©Īn)ė├├Ėś╦āx���ĪóīŻ(zhu©Īn)ė├Öz£y▄ø╝■
Lonza Łéų¼╠Ū�ĪóFlashGelķW─zŽĄĮy
Lonza Moda īŹ(sh©¬)“×╩ę╣▄└ĒŽĄĮyŻ©╬ó╔·╬’QC����ĪóųŲ╦ÄŲ¾śI(y©©)īŻ(zhu©Īn)ė├░µŻ®
IDT Alt-R CRISPR-Cas9╗∙ę“ŠÄ▌ŗŽĄĮy
IDT Alt-R CRISPR-Cas12a/Cpf1╗∙ę“ŠÄ▌ŗŽĄĮy